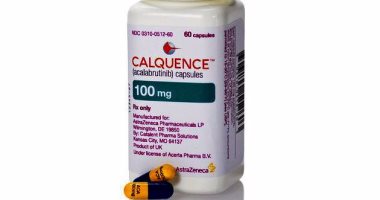
وافقت إدارة الغذاء والدواء الأمريكية "FDA" اليوم على عقار "Calquence" الذى يحتوى على المادة الفعالة (acalabrutinib) لعلاج سرطان الدم الليمفاوي المزمن (CLL) أو سرطان الغدد الليمفاوية الصغيرة (SLL).

وتمت الموافقة في البداية على "Calquence" في عام 2017 لعلاج البالغين المصابين بسرطان الغدد الليمفاوية لخلية الوشاح، لكنه تمت الموافقة عليه الآن كخيار علاج جديد أو كعلاج أولي أو لاحق للبالغين الذين يعانون من سرطان الدم الليمفاوي المزمن (CLL) أو سرطان الغدد الليمفاوية الصغيرة (SLL).
وقال "ريتشارد بازدور"، مدير مركز التميز للأورام التابع لإدارة الأغذية والأدوية بـ "FDA" : "استندت الموافقة التكميلية الجديدة إلى تجربتين سريريتين عشوائيتين شملت التجربة الأولى 535 مريضا يعانون من سرطان الغدد الليمفاوية المزمن ولم يتم علاجهم من قبل والثانية شملت 310 من المرضى الذين عولجوا بأدوبة أخرى من قبل.
وتشمل الآثار الجانبية الأكثر شيوعًا: فقر الدم ، قلة العدلات "خلايا المناعة" ، عدوى الجهاز التنفسي العلوي ، قلة الصفيحات الدموية، الصداع ، الإسهال وآلام العضلات والعظام.












تم أضافة تعليقك سوف يظهر بعد المراجعة